|
 |
Jak stworzyć ogniwo Volty przy pomocy kilku osób i kilku blaszek? |
Środki dydaktyczne:
- kilka par blaszek miedź – cynk (mosiądz – żelazo, miedź – aluminium) połączonych ze sobą przewodnikiem,
- woltomierz,
- 2 przewodniki do podłączenia z miernikiem,
- kilka osób chcących stać się „ludzkimi bateriami”.
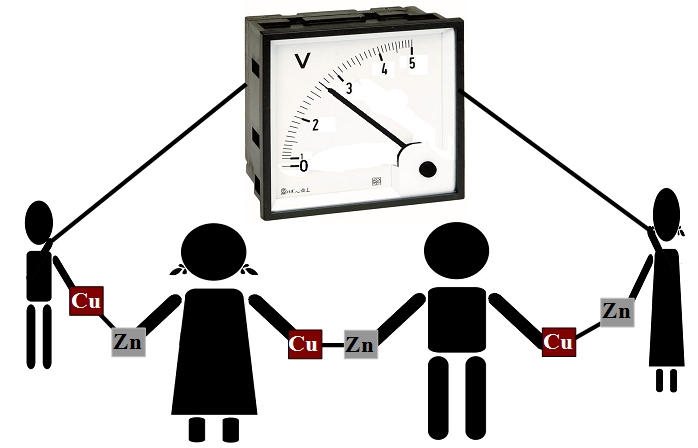
Schemat doświadczenia (pod koniec strony - film)
- Zaproś kilku kolegów, żeby pomogli Ci w doświadczeniu (liczba osób, które możesz zaprosić może być o 1 większa, niż liczba par blaszek, które posiadasz).
- Ustaw kolegów w rzędzie, a następnie rozdaj im pary złączonych ze sobą blaszek. Ustaw ich tak, żeby każdy z nich trzymał w prawej ręce blaszkę miedzianą, a w lewej blaszkę cynkową (lub odwrotnie) jak na schemacie powyżej. Przed złapaniem blaszki każda osoba może zwilżyć trochę ręce, np. przez chuchanie lub polizanie (niezbyt higieniczne, ale zabawne dla publiczności).
- Prawie już zbudowaną baterię chwilowo rozłączamy – jedna z osób puszcza jedną z trzymanych blaszek. Wówczas ostatnia osoba z prawej bierze do prawej ręki przewodnik, który zostanie podłączona do miernika. Analogicznie, ostatnia osoba z lewej strony bierze drugi przewodnik do lewej ręki.
- Kiedy woltomierz (ustawiony na zakres 5 V, lub zbliżony) zostanie włączony, zamknijcie obwód – osoba, która chwilowo puściła jedną blaszkę, ponownie ją łapie. Co zaobserwujesz?
Uwaga: Po wyjściu z klasy nie zapomnijcie umyć rąk.
Wyjaśnienie:
Po zamknięciu obwodu woltomierz wskazuje napięcie rzędu kilku V, zależny od ilości osób (a właściwie par blaszek) biorących udział w doświadczeniu. Ustawiając się w obwodzie ten sposób tworzymy szereg ogniw Volty, który wytwarza sumaryczne napięcie. Osoby biorące udział w doświadczeniu pełnią rolę elektrolitu w baterii. Zamiast nich można użyć kwaśnego ogórka, cytryny albo ziemniaka.
Dodatkowe informacje:
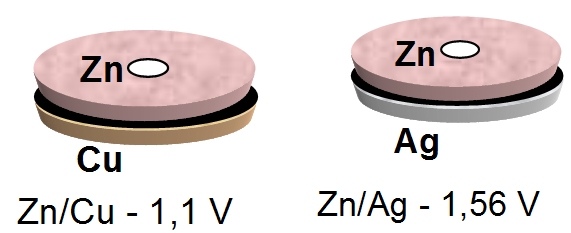
Ogniwo Volty jest bardziej urządzeniem chemicznym niż fizycznym: transport ładunku elektrycznego odbywa się za pośrednictwem reakcji chemicznych: redukcji (w terminologii fizycznej "przyłączanie elektronów") lub utleniania ("oddawania elektronów"). Tzw. potencjały elektrochemiczne są cechą charakterystyczną każdego metalu (zobacz Szereg elektrochemiczny). Znając ich wartości można policzyć jaki potencjał będzie miała (teoretycznie) bateria z danych metali np.: miedź – potencjał = +0,34 V, cynk – potencjał = -0,76 V. Różnica pomiędzy nimi to 1,1 V i teoretycznie tyle powinno wynosić napięcie baterii z nich zbudowanej. W praktyce z uwagi na różne czynniki np. niedoskonałe przewodnictwo styków pomiędzy płytkami i elektrolitem, to napięcie jest nieco mniejsze.
|
Jak wynaleziono baterie, które działające do dziś na tej samej zasadzie, co ogniwo Volty, bez których nie potrafilibyśmy się obejść? Odkrycie zapoczątkował Luigi Galvani.
Uczony , z racji wykonywanego zawodu (anatom i fizjolog), interesował się występowaniem elektryczności u ryb i innych zwierząt. Pewnego dnia w 1780 r. dokonując sekcji żaby zauważył, że iskry elektryczne ze stojącej obok maszyny elektrostatycznej wywołują skurcz mięśni ud żaby. Badając ten efekt odkrył on, że zetknięcie kawałkiem metalu mięśnia z nerwem w udzie żaby powoduje skurcz mięśnia. Galvani sprawdził także, że pewne metale wydają się być bardziej efektywne niż inne w wywoływaniu tego zjawiska. Na tej podstawie wyciągnął jednak błędny wniosek, że metal przesyła fluid, identyfikowany z „elektrycznością zwierzęcą”, od nerwu do mięśnia. Swoje spostrzeżenie Galvani opublikował w 1791 r. wzniecając tym w ówczesnym świecie nauki znaczne polemiki i spekulacje.
Rysunek z pracy Galvaniego
|
 |
Alessandro Volta odkrył w 1790 r. występowanie napięcia kontaktowego na styku dwóch różnych metali. Prace Galvaniego inspirowały Voltę do kontynuowania badań nad wpływem elektryczności na zmysł smaku, dotyku i wzroku.

Stos (z monet) Volty i bateria ze szklankami, Mauzoleum Volty, Como |
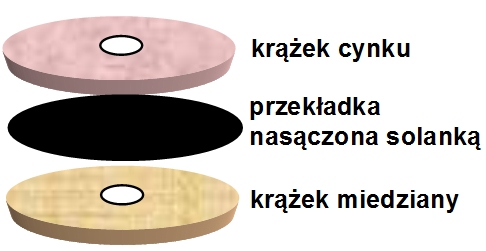
Kiedy Volta położył krążek metalowy na swoim języku, a krążek z innego metalu podłożył pod język, to poczuł słony smak w ustach. Podzielając początkowo poglądy Galvaniego przyjął, że ma do czynienia z „elektrycznością zwierzęcą”. Jednak w 1796 Volta odkrył, że może wytworzyć „elektryczność” zastępując język kartonem nasączonym solanką. Wywnioskował stąd, że przyczyną tego zjawiska jest kontakt pomiędzy metalem i wilgotnym ciałem; tym samym poddał rewizji swoje poglądy nt. elektryczności zwierzęcej i stał się antagonistą Galvaniego. |
Odkrycie zjawiska kontaktowego pozwoliło mu następnie na uporządkowanie wszystkich znanych metali w tzw. szereg napięciowy i przyczyniło się do zbudowania przez niego pierwszej działającej baterii elektrycznej.
|
Ok. 1800 r. Volta skonstruował stos złożony z warstw: srebra, wilgotnego kartonu i cynku, ułożonych w takiej kolejności, aby zaczynał się i kończył różnymi metalami. Kiedy Volta połączył srebro i cynk drutem, uzyskał efekt ciągłego przepływu elektryczności przez drut. Potwierdził też eksperymentalnie, że działanie jego stosu było w każdym przypadku równoważne działaniu wywołanemu przez elektryczność statyczną.
Tak więc bateria Volty była pierwszym wynalezionym w czasach nowożytnych źródłem stałego „ciągłego” prądu elektrycznego. Jej elementarne ogniwo wytwarzało wprawdzie mniejsze napięcie niż butelka lejdejska, ale było łatwiejsze do stosowania, ponieważ mogło dostarczać prądu stałego i nie musiało być doładowywane, w przeciwieństwie do tej ostatniej.
Ogniwa elektrochemiczne, którego działanie zostało wynalezione przez Voltę w 1797 roku, do dziś są niezastąpionymi elementami telefonów komórkowych, zegarków, komputerów, samochodów.
|
 |
Uwagi metodyczne:
- Szereg napięciowy Volty jest ustandaryzowanym sposobem na porównanie potencjałów elektrochemicznych różnych metali – usystematyzowane są one w odniesieniu do potencjału wodoru atomowego, według reakcji H ↔ H+ + e. Wodór atomowy powstaje z cząsteczki H2 w procesie dysocjacji na elektrodzie pokrytej nanostrukturalną platyną (tzw. czernią platynową).
- Potencjały elektrochemiczne zależą od rodzaju metalu i od wartościowości chemicznej, jaką metal w danej reakcji wykazuje. I tak reakcja Cu ↔ Cu+ + e i reakcja Cu ↔ Cu+2 + 2e mają różne potencjały, +0,52V i +0,34V , odpowiednio. Potencjał też może zależeć od odmiany alotropowej (czyli struktury krystalicznej) substancji. I tak fosfor czerwony i szary dają różne potencjału, P(czerwony) -0,11V, P(szary) -0,06V.
- Potencjał, teoretycznie, nie zależy od rodzaju elektrolitu: i destylowana woda, i roztwór soli i rozcieńczony kwas siarkowy jak w ogniwie Volty, działają; oczywiście, w destylowanej wodzie jest tak mało jonów (10-7 w stosunku do cząsteczek wody), że opór wewnętrzny jest bardzo duży, a przez to użyteczne napięcie lub prąd małe.
- Opór wewnętrzny ogniwa złożonego z uczniów (kontakt i opór elektryczny ciała człowieka, rzędu megaomów) są powodem, że napięcie użyteczne z takiego ogniwa jest znacznie mniejsze niż przewidywane.
- Co nie zmienia faktu, że gdy odczytamy 3,7 V lub więcej można zażartować: „Wiecie już co zrobić, gdy wyczerpie się bateria w komórce? Zaprosić koleżanki!”
|
Reakcja
|
V
|
|
Ag ↔ Ag+2 + 2e
|
+1,98
|
|
Ag ↔ Ag+ + e
|
+0,80
|
|
Cu ↔ Cu+ + e
|
+0,52
|
|
Cu ↔ Cu+2 + 2e
|
+0,34
|
|
H ↔ H+ + e
|
0
|
|
PH3↔ P (szary) + 3 H+ + 3e
|
-0,06
|
|
PH3↔ P (czerwony) + 3 H+ + 3e
|
-0,11
|
|
Zn ↔ Zn+2 + 2e
|
-0,76
|
Szereg elektrochemiczny pierwiastków (wybrane pozycje)[3]
JW Player goes here
Ogniwo Volty z ciałem człowieka jako elektrolitem
KS, GK
Na podstawie:
[1] G. Karwasz, A. Karbowski, Na końcu języka (Volty).., Foton 96, Wiosna 2007, 34.
[2] A. Okoniewska, G. Karwasz, Volta... i popłynął prąd
[3] Robert C. Weast ed., CRC Handbook of Chemistry and Physics (67th ed.), Boca Raton, FL: CRC Press, 1986
[4] Eksperymenty historyczne w nauczaniu fizyki, TopKurier, Toruń 2002
|
|