- Ciała stałe
- Piryt i ametyst
- Sprytna plastelina
- Topnienie lodu
- Stop Wooda
- Gazy
- Balonik na kolbie
- Balonik pod kloszem
- Termometr miłości
- Wrzenie wody pod zmniejszonym ciśnieniem
- Ciecze
- Naczynia połączone
- Naczynia kapilarne
- Tornado w butelce
- Ruch konwekcyjny
- Plazma
- Elektroskop i świeca
- Tornado ogniowe
- Lampa plazmowa
- Induktor
- Kondensat
Wrzenie wody
Co więcej, aby woda wrzała, nie wystarczy doprowadzić ją do 100ºC – trzeba dostarczyć jeszcze dodatkowo sporej ilości ciepła: 540 cal na każdy gram wody (540cal x 4,2J/cal= 2268J). To jest tak jakby podgrzać wodę o dodatkowe 540ºC. Stąd się biorą tajfuny (zobacz tutaj). Tak duże są siły spójności między cząsteczkami wody w fazie ciekłej (gdy są blisko siebie).
Skąd się bierze ciepło, gdy wrze woda (pod obniżonym ciśnieniem) w temperaturze 20ºC, a nie ma żadnej grzałki? Z reszty wody! Cząsteczki wody są w ciągłym ruchu [ref. Ruchu Browna] i ciągle się zderzają: jedne w tych zderzeniach oddają energię kinetyczną, inne je otrzymują. Jeśli cząsteczka uzyska tej energii dostatecznie dużo, opuszcza fazę ciekłą, czyli paruje. Jeśli dzieje się to nie tylko na powierzchni, ale i w objętości – ciecz wrze.
Jak sprawdzić, czy rzeczywiście ciepło potrzebne do wrzenia pochodzi z reszty cieczy? To proste! Pozostała w kolbie (lub szklance) woda jest zimniejsza niż początkowo. O tyle zimniejsza, i dłużej trwało wrzenie.
Z tego powodu na najwyższym szczycie Rys w Tatrach (2503 m n.p.m.) przy ciśnieniu 740 hPa woda wrze w 92ºC, na szczycie Mont Everest (8 848 m n.p.m.), przy ciśnieniu 310 hPa – w temperaturze 68ºC, a przy prawie zerowym ciśnieniu – w temperaturze niewiele większej niż 0ºC.
Takie warunki, gdy woda wrze, a jednocześnie krzepnie w lód, czyli współistnienie trzech faz wody, nazywamy punktem potrójnym, i służy on do definicji skali temperatury. Punkt potrójny wody to 0,01°C przy ciśnieniu 611,73 Pa (mniej niż jedna setna atmosferycznego).
Ogólnie, dla wszystkich substancji obserwujemy zależności temperatury wrzenia (i topnienia) od ciśnienia. Takie zależności nazywamy wykresami fazowymi:
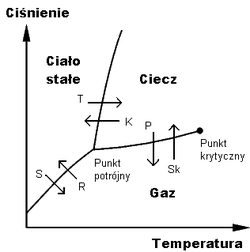
Rys. 2. Przykład wykresu stanu równowagi fazowej.