- Ciała stałe
- Piryt i ametyst
- Sprytna plastelina
- Topnienie lodu
- Stop Wooda
- Gazy
- Balonik na kolbie
- Balonik pod kloszem
- Termometr miłości
- Wrzenie wody pod zmniejszonym ciśnieniem
- Ciecze
- Naczynia połączone
- Naczynia kapilarne
- Tornado w butelce
- Ruch konwekcyjny
- Plazma
- Elektroskop i świeca
- Tornado ogniowe
- Lampa plazmowa
- Induktor
- Kondensat
Balonik pod kloszem
Taką przemianę gazową jak w baloniku pod kloszem próżniowym nazywamy przemianą izotermiczną, czyli zachodzącą przy stałej temperaturze. I rzeczywiście, wypompowanie powietrza nie powoduje zmiany temperatury pod kloszem [foto termometrem pod kloszem].
W przemianie izotermicznej gdy maleje ciśnienie p , rośnie objętość V, jaką gaz zajmuje, zgodnie z równaniem pV= const. Mówimy, że dwie wielkości p i V są odwrotnie proporcjonalne. Równanie pV=cont nazywamy również prawem Boyle’a-Mariotta (jeden był Anglikiem, drugi Francuzem).
Nie jest łatwo znaleźć „prawdziwą” przemianą izotermiczną – gdy pompujemy oponę w rowerze, temperatura powietrza w pompce rośnie. Gdy wydmuchujemy powietrze z ust, ciśnienie maleje, ale i temperatura gazu nieco maleje.
Przemianą „prawie” izotermiczną jest puchnięcie balonów stratosferycznych. Wypuszczone z powierzchni ziemi są one „sflaczałe” – do balonu zostaje wpuszczone tyle helu, aby nie balon nie pękł na wysokości 30 km. Na tej wysokości ciśnienie jest rzędu 1/200 ciśnienia atmosferycznego, i balon „puchnie”, jak pod kloszem pompy próżniowej.


Rys. 2. Balon Felisa Baumgartnera: a) na Ziemi, b) w stratosferze.
Balon Felisa Baumgartnera („Red Bull Stratos” 2012) – na Ziemi (pustynia w Nowym Meksyku) i w stratosferze (na wysokości 40 km, gdzie ciśnienie atmosferyczne jest 1/200 ciśnienia na powierzchni ziemi): balon spuchł mniej więcej 6xkrotnie (tzn. jego objętość wzrosła 63≈200). Nie jest to dokładnie przemiana izotermiczna, bo temperatura na tej wysokości jest nieco niższa niż na powierzchni ziemi.
Temperatura w stratosferze rośnie z wysokością, odmiennie niż w troposferze, gdzie spada aż do -55ºC na wysokości 10-11 km. Powodem wzrostu temperatury w stratosferze jest obecność ozonu – to on absorbuje promieniowanie nadfioletowe (a właściwe pozostałość z tego promieniowania, tzw. UVB, nie zaabsorbowaną w wyższych warstwach atmosfery przez tlen i azot atomowy).
Wypuszczenie gazu ze zbiornika w próżnię, wbrew częstemu mniemaniu, jest przykładem przemiany izotermicznej. Gaz nie absorbuje ciepła Q, ale rozprężając się nie wykonuje też pracy W. Zgodnie więc z I zasadą termodynamiki ΔU=Q-W, jego energia wewnętrzna U nie zmienia się. A ponieważ U=nkT, gdzie n – jest ilością moli gazu, a R - stałą gazową (8,31 J/mol•K), temperatura nie zmienia się. Tego rodzaju przemianę, w odróżnieniu od wydmuchiwania powietrza z ust (na zewnątrz panuje ciśnienie atmosferyczne) nazywamy ekspansją swobodną.
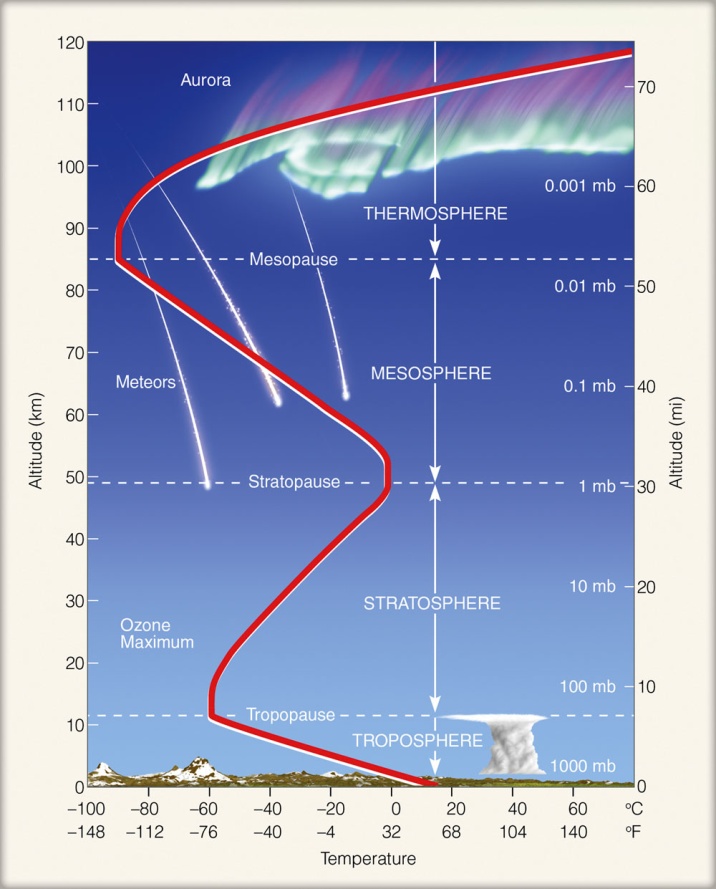
Rys. 3. Ciśnienie w warstwach atmosfery (foto:tes.com)