Cytryna, kartofel a nawet ludzkie dłonie z dwoma różnymi metalami tworzą tzw. ogniwo galwaniczne. Miliony takich ogniw jest codziennie zużywanych w telefonach, komputerach, walkmanach i zegarkach.


Cytrynowa bateria jest przykładem takiego ogniwa galwanicznego: prąd elektryczny powstaje w wyniku reakcji elektrochemicznych. Elektrody stanowią płytki - cynkowa i miedziana; elektrolitem jest wodny roztwór różnych kwasów znajdujących się w każdym warzywie lub owocu. Ale nic za nic - płytka cynkowa z czasem się w cytrynie "rozpuści" a na miedzianej uzbiera się brudny nalot. Pierwszy zauważył to medyk, Luigi Galvani, na żabich udkach, zawieszanych na żelaznych haczykach, kiedy dotykały miedzianego drutu. Zauważył, ale wierzył do końca, że to żaba jest źródłem elektryczności, a nie energia chemiczna z żelaza i miedzi.
A więc tona ziemniaków i można oglądać telewizję (pozornie) za darmo! Tylko, kto da ci cynk?
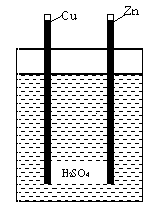
Pierwsze użytkowe ogniwo Volty składało się z płytek Cu i Zn zanurzonych w szklance z kwasem. Każde ogniwo można uważać za dwa półogniwa. Półogniwo - to elektroda metaliczna zanurzona do odpowiedniego roztworu. Na elektrodach tych przebiegają reakcje utleniania (na anodzie, czyli elektrodzie ujemnej) oraz redukcji (na katodzie, czyli elektrodzie dodatniej). Półogniwa połączone są ze sobą za pomocą przewodnika prądu elektrycznego, co umożliwia przepływ elektronów z elektrody ujemnej na elektrodę dodatnią.
W naszym przypadku elektrolitem jest wodny roztwór różnych kwasów znajdujących się w każdym warzywie lub owocu. Na płytce cynkowej zachodzi utlenianie, a więc cynk jest anodą (elektrodą ujemną):
Zn(s) → Zn2+ + 2e
Jony cynkowe wędrują od powierzchni anody w głąb roztworu, a elektrony poruszają się w przewodniku od płytki cynkowej do miedzianej. Na płytce miedzianej zachodzi redukcja, a więc jest ona katodą.
Elektrony, które docierają przez przewodnik gromadzą się na powierzchni katody, skąd są pobierane i zużywane w reakcji:
Cu2+ + 2e → Cu(s)
W ten sposób jony miedziowe są usuwane z roztworu, a na ich miejsce dyfundują jony cynkowe. W ogniwie te samorzutnie przebiegające reakcje wytwarzają prąd elektryczny.
Oczywiście, w kierunku elektrody miedzianej wędrują nie tylko jony miedzi, ale w szczególności jony wodoru, które tam się wydzielają w postaci gazu.
Ogólnie, elektrochemia to pożyteczna, stara (od wynalezienia ogniwa Volty minęło 200 lat), ale wciąż niejasna nauka.