Klatraty hydratów czyli palący się „metanowy lód”
Tekst: prof. dr hab. Helena Dodziuk
Credit: U.S. Geological Survey Department of the Interior/USGS U.S. Geological Survey
Ostatnio głośno się zrobiło o tzw. palącym się, inaczej metanowym lodzie (ang. flammable ice).1< Zbudowany on jest z klatratów hydratów - utworzonych przez cząsteczki wody klatek, w których wnętrzu ‘schowane’ są często węglowodory takie jak metan CH4.2 W metrze sześciennym metanowego lodu zawarte jest poza wodą 160 metrów sześciennych czystego metanu. Znanych jest 15 różnych postaci krystalicznych wody w ciele stałym.3 Najbardziej popularną z nich jest lód o symetrii Ih, takiej samej jak cząsteczka dodekahedranu (1) i fulerenu C60 (2).
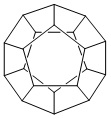 1
1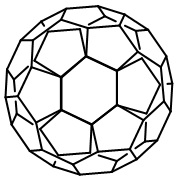 2
2W przypadku lodu o tej symetrii każdy wierzchołek we wzorze pierwszym zastąpiony jest przez atom tlenu, a wiązanie CC wiązaniem OH plus wiązaniem wodorowym H...O (rys. 3).
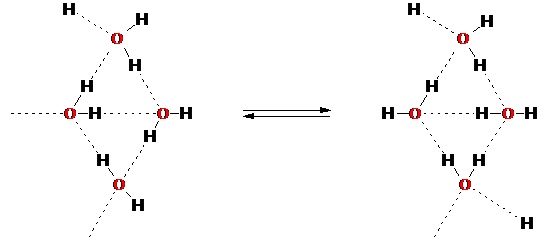
Rys 3. Dynamiczna struktura wiązań wodorowych utworzonych na fragmencie dodekahedranu 1.
Wiązania wodorowe są bardzo słabe, więc układ jest dynamiczny. Jak pokazano na rys. 3, protony wędrują między pozycjami atomów tlenu tworząc wiązanie OH raz z jednym, raz z drugim sąsiednim atomem tlenu. A więc, „wodne klatki” nie są strukturami sztywnymi i trwałymi. Ich trwałość znacznie wzrasta, gdy (podobnie jak w przypadku endohedralnych kompleksów fulerenów4) w środku ich są inne, niepolarne cząsteczki gości. Mogą to być (oprócz wspomnianego już metanu) O2, H2, N2, CO2, H2S, Ar, Kr, i Xe, niektóre wyższe węglowodory oraz freony (halogenowe pochodne węglowodorów), które tworzą hydraty w odpowiednich warunkach temperatury i ciśnienia.5 Stwierdzono, że małe cząsteczki gości bardziej stabilizują mniejsze klatki, natomiast większe cząsteczki są bardziej stabilizowane w większych klatkach. Jednak, ze względu na labilność wiązań wodorowych, ta sama cząsteczka gościa może tworzyć stabilne klatraty w różnych klatkach. Np. cztery typy struktur znaleziono dla Na+(t-Bu4)Br6. Z drugiej strony, jak pokazano w grupie Ripmeestera,7 cząsteczka gościa może szybko poruszając się w klatracie zajmować wiele różnych pozycji.
Uważa się, że klatraty hydratów pierwszy zaobserwował Davy w 1810 roku.8 W warunkach laboratoryjnych po raz pierwszy klatrat dwutlenku węgla został otrzymany w roku 1882 przez polskiego fizyka Zygmunta Wróblewskiego z kwasu węglowego.
Niestety metan CH4, który jest najbardziej wydajnym źródłem energii z klatratów, jest jednocześnie gazem cieplarnianym, o dużo bardziej niebezpiecznych skutkach niż CO2 (nawet kilkadziesiąt razy, patrz Global-warming potential), więc oceniając to nowe źródło energii trzeba również badać jego wpływ na ekologię. Uważa się, że co najmniej jedno masowe wymieranie zwierząt (do 96% gatunków morskich, 70% kręgowców i jedyne znane wymieraie owadów) przed ok. 252 milionami lat na granicy permu a triasu (zwane wielkim wymieraniem) mogło być spowodowane przez gwałtowne uwolnienie metanu z klatratów.
Z klatratami hydratów jako źródłem energii wiązane są ogromne nadzieje. Jednak obecnie sprawiają one znaczne kłopoty przy wydobywaniu ropy naftowej, gdyż tworząc się w rurach, którymi transportuje się ropę, zatykają je. Uważa się, że usuwanie złogów klatratów podnosi koszty ropy o ok. 10%. Co będzie w przyszłości? Zobaczymy. Ostatnie udane próby wydobycia przez Japończyków nastrajają optymistycznie.
Literatura
(1) https://www.nytimes.com/2013/03/13/business/global/japan-says-it-is-first-to-tap-methane-hydrate-deposit.html?pagewanted=all&_r=0 An Energy Coup for Japan: ‘Flammable Ice’; 2013.
(2) Dodziuk, H. Wstep do Chemii Supramolekularnej; Wydawnictwa Uniwersytetu Warszawskiego: Warszawa, 2002; 259-263.
(3) Praveen, T. K., Velumurgan, A. www.lpi.usra.edu/meetings/scssi2008/pdf/9014.pdf 2008.
(4) Dodziuk, H. J. Nanosci. Nanotechnol. 2007, 7, 1102-1110.
(5) https://en.wikipedia.org/wiki/Clathrate_hydrate Clathrate hydrate; 2013.
(6) Dyadin, Y. A., Bondariuk, I. V., Aladko, L. S. Zh. Strukt. Khim. 1995, 36, 1088.
(7) Udachin, K. A., Enright, G. D., Ratcliffe, C. I., Ripmeester, J. A. J. Am. Chem. Soc. 1977, 119, 11486.
(8) https://ethomas.web.wesleyan.edu/ees123/clathrate.htm Davy 1810; 2013.
Układ html: K. Rochowicz
