

Batterie del limone


La prima pila di Volta era una semplice colonna di monete. Volta sviluppò rapidamente una batteria più poco costosa - una serie di vetri con acido solforico, collegata dalle strisce di rame e zinco (vedi la foto). Ogni "mezzo"vetro, con uno dei due elettrodi e metà dell'acido può essere considerato come una pila elementare. Sugli elettrodi si presentano reazioni di ossidazione o di riduzione. Sull'anodo, cioè l'elettrodo negativo (nel caso della pila di Volta l'elettrodo è Zn) avviene la reazione di ossidazione; sul catodo, cioè l'elettrodo positivo (elettrodo Cu) avviene la reazione di riduzione. Gli elettroni viaggiano attraverso i nastri metallici da una della metà-pila all'altra.
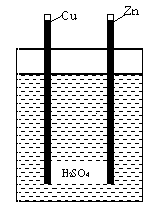
Nel caso della pila del limone, l'elettrolito è la soluzione di molti acidi che sono presenti in tutta la verdura o frutta. La reazione sull'anodo dello Zn è la seguente:
Gli ioni dello zinco vengono dissolti nell'elettrolite e gli elettroni passano alla piastra di Cu. Sull'elettrodo di Cu gli ioni del rame Cu2+ (o H+) sono ridotti dagli elettroni ricevuti dalla piastra collegata dello Zn; il Cu metallico è depositato sul catodo.
In questo modo, gli ioni del Cu (se presente) sono rimossi dalla soluzione e si sostituiscono agli ioni dello Zn. L'energia elettrica è generata dalle reazioni chimiche. Come detto prima, non soltanto gli ioni di Cu2+ ma anche quelli di H+ possono essere depositati sull'anodo e possono formare idrogeno H2 in forma gassosa.
L' elettrochimica è una scienza relativamente vecchia (Volta ha inventato la sua prima pila oltre 200 anni fa) ma il fenomeno discusso sopra non è stato ancora compreso completamente.