

Batterie au citron


Le premiere pile de Volta utilisable était composée de deux plaques de Cu et Zn, noyées dans un verre d'acide. Chaque pile peut ętre considérée comme deux demi piles. Une demi pile - c'est une électrode métallique noyée dans une opportune solution. Sur ces électrodes se passent des réactions d'oxydation (sur l'anode, l'électrode négative) et de réduction (sur la cathode, l'électrode positive). Les demi piles sont reliées ŕ l'aide d'un conducteur de courant, qui rend possible le flux d'électrons de l'électrode négative ŕ l'électrode positive.
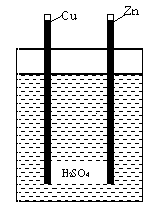
Dans notre cas, l'électrolyte est une solution aqueuse de différents acides qui se trouvent dans tout fruit ou légume. Sur la plaque en zinc se passe l'oxydation, donc le zinc est l'anode (électrode négative) :
Les ions zinc migrent de la surface de l'anode ŕ l'intérieur de la solution, et les électrons bougent dans le conducteur de la plaque en zinc ŕ la plaque en cuivre. Sur la plaque en cuivre se passe une réduction, donc elle est la cathode.
Les électrons, qui arrivent ŕ travers du conducteur s'accumulent sur la surface de la cathode, d'ou elles sont recueillis et consommés dans la réaction :
De cette maniere les ions cuivre sont éliminés de la solution, et ŕ leur place diffusent les ions zinc. Dans la pile ces réactions spontanées génerent le courant électrique.
Naturellement, en direction de l'électrode en cuivre ne migrent pas seulement les ions cuivre, mais surtout les ions hydrogene, qui lŕ sont libérés sous forme de gaz.
De façon générale, l'électrochimie est une science utile, vieille (de la découverte de la pile de Volta sont passés 200 ans), mais toujours pas claire.