

Die Zitronenbatterie


Das erste brauchbare galvanische Element von Volta bestand aus Kupfer- und Zinkplättchen in einem Glas mit einer Säure. Jedes galvanische Element kann man als zwei Halbelemente betrachten. Ein Halbelement ist eine Metallelektrode, die in eine Lösung getaucht wurde. An diesen Elektroden kommt es zu chemischen Reaktionen, und zwar zur Oxidation an der Anode (negative Elektrode) und zur Reduktion an der Katode (positive Elektrode). Die beiden Halbelemente sind über einen elektrischen Leiter miteinander verbunden, was den Elektronenfluss von der negativen zur positiven Elektrode sicherstellt.
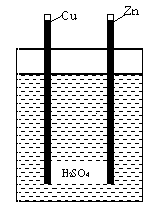
In unserem Fall ist der Elektrolyt eine Wasserlösung aus verschiedenen Säuren, die man in jedem Obst und Gemüse vorfindet. Auf der Zinkplatte kommt es zur Oxidation, so dass Zink die Anode bildet:
Die Zinkionen lösen sich von der Anodenoberfläche und wandern in die Lösung, die Elektronen jedoch laufen den Leiter entlang zum Kupfer. Auf dem Kupferplättchen kommt es zur Reduktion, somit bildet es die Katode.
EDie Elektronen aus dem Leiter sammeln sich auf der Oberfläche der Katode und werden in der chemischen Reaktion verbraucht:
Auf diese Weise verschwinden die Kupferionen aus der Lösung und an ihre Stelle treten die Zinkionen. In einer galvanischen Zelle erzeugen diese spontan ablaufenden Reaktionen elektrischen Strom.
Natürlich wandern nicht nur Kupferionen zur Kupferelektrode, sondern insbesondere auch Wasserstoffionen, die dann in Form von Gas abgesondert werden.
Allgemein ist Elektrochemie eine brauchbare und alte (seitdem Volta sein Element erfunden hat, sind schon 200 Jahre vergangen) und doch noch nicht ganz klare Wissenschaft.