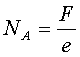
Wg pierwszego prawa elektrolizy Faradaya podczas przepływu prądu przez roztwór wydzielona ilość soli z roztworu jest proporcjonalna do ładunku, jaki przepłynął przez elektrolit. Do wydzielenia jednego mola jednowartościowej substancji potrzebny jest ładunek elektryczny równy 96485 Q. Ładunek taki nazywany jest stałą Faradaya F. Ponieważ każdy jon ma ładunek elementarny e, zatem liczba Avogadra równa będzie:
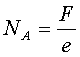
Ze względu na zależność pomiędzy stałą gazową R oraz stałą Boltzmanna k:
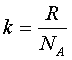
możliwe jest wyznaczenie liczby Avogadra korzystając z prawa gazu doskonałego pV=RT do wyznaczenia stałej gazowej oraz wykorzystując np. zjawisko osiadania cząstek koloidalnych w roztworze do wyznaczenia stałej Boltzmanna.
Kolejną metodą wyznaczenia stałej Avogadra jest wykorzystanie zależności pomiędzy masą atomową i molową
NAVatom=Vmol
Ponieważ w przypadku substancji krystalicznej liczba cząsteczek w jednostce objętości zależy od stałej sieci krystalicznej, to wyznaczając tą ostatnią np. metodą dyfrakcji promieniowania rentgenowskiego, możliwe jest wyznaczenie z dużą dokładnością liczby Avogadra.
Do wyznaczania liczby Avogadra stosowane jest także zjawisko emisji cząstek a. Jeśli mianowicie znana jest stała rozpadu preparatu promieniotwórczego, to możliwe jest wyznaczenie ilości atomów helu powstałych z cząstek a w określonym czasie w jednostkowej objętości, a co za tym idzie także liczby Avogadra.